#Ciência et al. (Especiais temáticos repletos de informações científicas)
Como e por que estudamos a relação entre genes e o envelhecimento?
| DESTAQUES: – O envelhecimento está relacionado com inúmeras doenças; – Fatores genéticos interferem em como o envelhecimento afeta cada pessoa; – Novo método (GWAS) aumentou o poder de estudos de reconhecimento de quais são esses fatores genéticos; – Assim, cientistas podem aprimorar o conhecimento sobre envelhecimento e desenvolver métodos de diagnóstico e tratamento contra doenças relacionadas a ele. |
ESTUDOS PIONEIROS
Por que sabemos tão pouco sobre o envelhecimento? Como é que podemos pesquisar o envelhecimento humano, já que pessoas vivem tempo demais para serem estudadas com esse fim? Como é que podemos saber o que é bom ou não para envelhecer bem? Envelhecer é um processo tão natural que, exatamente por fazer parte da nossa vida, pode deixar de ser especialmente intrigante. Mas, há muitas décadas, estas perguntas não passam despercebidas pela mente de cientistas. Uma das mais importantes discussões dentro da ciência gira em torno de tentar entender por que os organismos envelhecem. É importante destacar que o envelhecimento aparece como a principal causa de diversas doenças, como Alzheimer e diabetes do tipo 2, bem como alguns tipos comuns de câncer, como de próstata e mama. Sabe-se que inúmeros processos celulares podem interferir no controle da longevidade, mas nem sempre foi assim, já que por muito tempo os efeitos do ambiente, como acesso a remédios, saneamento básico ou fatores nutricionais, foram os únicos relacionados à longevidade. Todas essas associações permitem aos profissionais da saúde orientar os pacientes sobre como envelhecer de maneira saudável e com poucas complicações.
No final dos anos 1980 e começo da década de 90, cientistas da área de genética descobriram um fenômeno interessantíssimo. Animais, mesmo alimentados da mesma maneira e mantidos no mesmo ambiente, apresentavam, ainda assim, tempo de vida variado. Isso sugeriu que o ambiente não era o único fator que poderia interferir na longevidade. Mas, o que mais poderia estar envolvido? Grande parte do que somos é produzido por genes, elementos presentes em nosso DNA que são responsáveis por definir a cor dos nossos cabelos, nossa altura, cor de pele, quais enzimas e em que quantidade serão produzidas depois que nos alimentamos, e muito mais. Uma pergunta que pareceu óbvia para aqueles cientistas foi se algum gene, ou até mesmo um grupo deles, poderia ser responsável por regular o quanto vivemos.
Acontece que estudar o envelhecimento não é uma tarefa fácil. Animais comuns em laboratório, como ratos e camundongos, podem viver alguns anos, o que torna um projeto de pesquisa bastante caro e com a necessidade de cientistas trabalhando, às vezes, por décadas para responder umas poucas perguntas. Uma maneira de contornar estes problemas foi a utilização de um modelo biológico muito mais barato e com o tempo de vida curto. Seu nome científico é Caenorhabditis elegans, um verme mais comumente conhecido pelo seu nome reduzido C. elegans. Este é um animal pequeno, medindo aproximadamente 1 milímetro, que vive em média 20 dias e pode ser mantido em espaços muito reduzidos em comparação com os grandes biotérios necessários para a manutenção de outros animais, como camundongos ou ratos. Pode parecer estranho usar um verme para entender o nosso envelhecimento, mas mesmo animais tão diferentes possuem várias características semelhantes entre si, como o controle da mobilidade, regulação metabólica, comportamentos de acasalamento, dentre outras, governadas por genes e mecanismos equivalentes. Os genes conservados evolutivamente entre diversos organismos vivos, os quais compartilham uma sequência ancestral comum, são chamados homólogos. O verme, mesmo não sendo um mamífero, possui aproximadamente 40% de genes homólogos com os seres humanos e tem diversas vias metabólicas, de regulação e de sinalização que funcionam de maneira similar aos mamíferos. Isso permite que ele seja um bom modelo para os estudos de envelhecimento, com potencial para a compreensão do mesmo processo em humanos.
Os cientistas, intrigados em entender o envelhecimento, utilizaram uma estratégia simples e eficiente: alterar genes através de mutações aleatórias e medir o tempo de vida, comparando sempre com o animal selvagem, que não tem mutações. As descobertas foram impressionantes. Mutações que interrompiam o funcionamento de dois genes, separadamente, eram capazes de aumentar o tempo de vida destes pequenos animais em aproximadamente 40%. Isso indicava pelo menos duas coisas muito interessantes: a primeira delas é que, diferente do que se poderia pensar, o tempo de vida de cada espécie não é imutável; a segunda é que esta regulação pode ser feita geneticamente, o que possibilitou o uso das diversas técnicas clássicas já utilizadas na genética também para o estudo do envelhecimento.
Não coincidentemente, os dois genes identificados fazem parte do mesmo sistema: o controle da entrada de glicose na célula destes animais. Este mecanismo é utilizado por outros animais, inclusive nós, seres humanos. A fim de verificar o efeito de alterações nesses genes em outros animais, pesquisadores usaram moscas e camundongos em testes, mostrando que quando um destes genes é alterado e deixa de funcionar, estas espécies também têm aumento no tempo de vida. Curiosamente, alguns grupos de humanos com maior proporção de pessoas que atingem os 100 anos também apresentam alterações neste gene. Ou seja, estes genes não regulam a longevidade só nos vermes, mas nos animais de forma geral.
Da década de 1990 até os dias atuais, nosso conhecimento a respeito do processo de envelhecimento aumentou consideravelmente. Hoje, sabe-se que estes genes fazem parte de uma complicada teia que envolve outros genes, moléculas e diferentes mecanismos de regulação. Além disso, os cientistas destacam também que em mamíferos, como os seres humanos, os principais responsáveis pelo envelhecimento celular são as instabilidades do genoma. É sobre algumas destas descobertas que gostaríamos de falar para vocês.
RELACIONANDO GENOMAS COM ENVELHECIMENTO
Além dos trabalhos com animais modelo, como dito anteriormente, grande parte dos avanços no conhecimento nos últimos anos decorre do desenvolvimento de tecnologias de sequenciamento, bem como dos métodos computacionais para analisar estes dados. O verme C. elegans, a mosca da fruta (Drosophila melanogaster) e o camundongo (Mus musculus) são exemplos de animais modelo que já têm genoma conhecido e para os quais já temos tecnologias que permitem o planejamento de experimentos envolvendo mutação ou silenciamento de genes, facilitando a avaliação da relação entre genótipo e fenótipo. Isso também os torna destaque na pesquisa sobre envelhecimento, uma vez que esta depende, em muito, da manipulação genética.
O sequenciamento do genoma humano, resultado de um projeto que teve início há aproximadamente 30 anos e teve uma versão finalizada em 2003, deu abertura a uma série de possibilidades para os estudos sobre doenças humanas. Por exemplo, foi possível fazer estudos em larga escala sobre mutações no DNA. Além dos estudos da própria organização do genoma, o seu sequenciamento deu abertura para estudos de expressão gênica, do efeito do ambiente sobre os genes etc. Apesar de emergentes, estudos em genética da longevidade ainda são bem menos avançados que os da genética de doenças complexas.
Sabemos também que o ambiente desempenha um papel importante no envelhecimento. Entretanto, em ambiente natural, muitas variáveis podem interferir nos resultados, o que torna imprescindível o uso de um laboratório com ambiente controlado para a identificação mais precisa das causas do fenômeno estudado. Como a manipulação em laboratório é facilitada em modelos animais, é possível alterar diferentes condições e avaliar o papel de fatores como dieta, diferentes tipos de estresse e até mesmo de infecções microbianas. O uso destes modelos é, portanto, o ponto de partida para muitos dos estudos com pessoas, já que o controle de variáveis em populações humanas é muito mais complexo e caro do que os realizados em laboratório. Apesar disso, o ambiente artificial criado e controlado na pesquisa com animais de laboratório para testes experimentais pode não refletir exatamente os fenômenos que ocorrem em outras espécies. É importante, então, que experimentos como estes sejam também realizados em grupos humanos, de forma controlada, para que tenhamos mais confiabilidade nos resultados.
Em humanos, estudos recentes que visam entender melhor o papel dos genes nas nossas características herdadas têm sido realizados principalmente com gêmeos e com informações de famílias. Por exemplo, em um estudo com dados do Reino Unido, os cientistas analisaram 20.000 pessoas entre 50 e 60 anos de idade e coletaram informações associadas ao tempo de vida de seus pais. Eles observaram que as pessoas tinham menor taxa de mortalidade quando seus pais haviam morrido após os 65 anos, e também verificaram uma menor incidência de doenças cardiovasculares, câncer ou menor declínio cognitivo em pessoas cujos pais haviam vivido mais tempo.
E, então, onde entra a genômica? Genes relacionados com o envelhecimento têm sido descobertos com ajuda de um tipo de estudos chamado “Estudos de Associação Genômica Ampla”, conhecidos pela sigla em inglês GWAS (Genome-wide Association Studies). Neste tipo de estudo, testes estatísticos são realizados para associar um fenótipo ao genótipo de um grande número de indivíduos. Assim, um estudo pode identificar, por exemplo, que uma mutação em um determinado gene está presente em grande parte das pessoas que apresentam sinais de idade mais cedo, ao mesmo tempo que é rara entre os que envelhecem mais tardiamente, apontando para uma possível importância deste gene no processo de envelhecimento (ver figura 1 para outro exemplo).
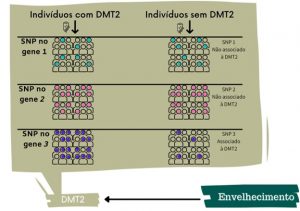
Algo interessante nesses estudos de GWAS é a descoberta de regiões no genoma que estão associadas com uma determinada característica, mas a relação com ela era até então desconhecida. Como vemos no Ensino Médio, as proteínas são formadas por uma sequência de aminoácidos, que é decisiva para a determinação de sua estrutura tridimensional (Figura 2a). Há dois tipos de mutações que podem ocorrer em uma sequência de DNA que codifica uma proteína: mutações sinônimas (sem alteração na sequência da proteína) e não sinônimas (com alteração). Substituições com alteração podem ter substituição de aminoácido (também conhecida como mutação missense) ou a interrupção da produção da proteína completa. Alterações não sinônimas podem alterar a estrutura, causando um impacto negativo na função desempenhada pela proteína e no contexto da doença estudada. Um exemplo de mutação missense é apresentado na ilustração da Figura 2b.
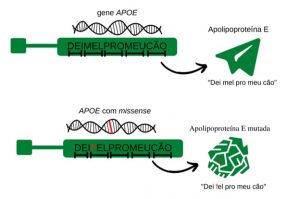
Sobre a associação entre genótipo e fenótipo encontrada em análises de GWAS, não é possível determinar a relação de causa e efeito. Para poder determinar essa relação de causalidade, os cientistas costumam fazer análises que chamamos de caracterização funcional. Um exemplo disso é o uso de modelos animais geneticamente modificados para não ter o funcionamento normal do gene de interesse. Foi usando camundongos com prejuízos no gene APOE (citado na figura 2) que cientistas puderam verificar que este gene protege contra inúmeras doenças relacionadas ao envelhecimento, tais como aterosclerose, problemas neurodegenerativos e até mesmo o controle dos níveis de LDL, considerado um dos grandes vilões para a saúde quando a idade avançada vai chegando.
De maneira geral, o envelhecimento é um tema bastante complexo e é difícil definir o que é causa e o que é consequência dele. O importante é ter cada vez mais estratégias de mapear pontos de regulação para prevenção de doenças relacionadas com o envelhecimento e até mesmo tentar melhorar o funcionamento celular, fazendo com que nosso organismo envelheça mais lentamente e de forma mais saudável. Para isso, a ciência vem nos ajudando há muitas décadas e as tecnologias de sequenciamento e ferramentas para análises destes dados são peças fundamentais, além de serem, provavelmente, o meio pelo qual continuaremos traçando o caminho do conhecimento pelas próximas gerações.
Colaboração:
Hiago Freire Oliveira
Graduando em biologia, estuda o desenvolvimento de métodos de predição de interação entre piRNAs e elementos transponíveis por aprendizado de máquina. No tempo livre, gosta de ouvir jazz. No tempo não livre, também.
Renato Augusto Corrêa dos Santos
Bioinformata, cientista, educador e divulgador de ciência. Doutorando em Genética e Biologia Molecular. Estuda genomas de espécies de Aspergillus causadoras de aspergilose, antifúngicos e o problema de resistência a antifúngicos.
Silas Pinto da Silva
Mestre em Biologia Molecular e doutorando em Genética e Biologia Molecular. Estuda biologia molecular do envelhecimento e intervenções com potencial de prevenir doenças relacionadas ao envelhecimento. Além disso, adora animais, jogos de estratégia e RPG.
Fontes consultadas:
– Artigo científico intitulado “Association, correlation and causation”, publicado na revista Nature Methods em 2015, de autoria de Altman, N. e Krzywinski, M.
– Artigo científico intitulado “Benefits and limitations of genome-wide association studies”, publicado na revista Nature Reviews Genetics em 2019, de autoria de Tam, V., Pattel, N., Turcotte, M., e colaboradores.
– Artigo científico intitulado “The nematode Caenorhabditis elegans as a model for aging research.”, publicado na revista Drug Discovery Today: Disease Models em 2018, de autoria de Mack, H., Heimbucher, T. e Murphy, C.
– Artigo científico intitulado “A C. elegans mutante that lives twice as long as wild type”, publicado na revista Nature em 1993, de autoria de Kenyon, C., Chang, J., Gensch, E. e colaboradores.
– Artigo científico intitulado “Human insulin/IGF-1 and familial longevity at middle age”, publicado na revista Aging (Albany NY) em 2009, de autoria de Rozing, M., Westendrop, R., Frölich, M. e colaboradores.
– Artigo científico intitulado “The genetics of human ageing.”, publicado na revista Nature em 2020, de autoria de Melzer, D., Pilling, L., e Ferrucci, L.
– Artigo científico intitulado”Studying aging in Drosophila”, publicado na revista Methods em 2014, de autoria de He, Y. e Jasper, H.
– Capítulo de livro intitulado “Integrative genomics of aging.”, de autoria de de Magalhães, J., Lagger, C. e Tacutu, R. , publicado no livro “Handbook of the Biology of Aging” pela editora Academic Press em 2021.
– Livro “Fundamentos de Genética”, de autoria de Snustad, D. e Simmons, M., publicado pela editora Guanabara em 2008. 4a ed.
– Site do NIH sobre genoma (https://www.genome.gov/about-genomics/fact-sheets/Genome-Wide-Association-Studies-Fact-Sheet).
– Site do Projeto Genoma Humano (https://www.genome.gov/human-genome-project).

- Quer ser o próximo autor colaborador do Ilha do Conhecimento? Participe!
- Não perca mais nenhuma postagem: Acompanhe nosso projeto nas redes sociais!
(Editoração: Beatriz Spinelli, Fernando Mecca e Loren Pereira)

