#Ciência et al. (Especiais temáticos repletos de informações científicas)
Do surgimento da técnica de produção de miniórgãos funcionais em laboratório às aplicações como modelos de estudo com SARS-CoV-2
| DESTAQUES: – Miniaturas de órgãos funcionais produzidos em laboratório a partir de células-tronco são chamadas de miniórgãos, ou organoides; – A geração desses miniórgãos foi possível graças ao entendimento da via de sinalização Wnt das células-tronco Lgr5+; – Os miniórgãos são capazes de recapitular alguns aspectos de seu tecido de origem e são estáveis; – As aplicações dos miniórgãos vão desde estudos sobre biologia do desenvolvimento de órgãos a modelos de doenças, como fibrose cística e câncer. |
Você já ouviu falar em laboratórios que produzem miniórgãos? Pois acredite, essa realidade está mais próxima do que imaginávamos! Na última década, diversos grupos de pesquisa pelo mundo vêm aperfeiçoando as técnicas de cultivos celulares para desenvolver em laboratório (in vitro) miniaturas de órgãos funcionais, também conhecidos como organoides, a partir de células-tronco. Um dos pioneiros na criação desses miniórgãos foi o biólogo Hans Clevers, diretor do Instituto Hubrecht (Utrecht, Holanda), que lidera um grupo de pesquisa focado nos mecanismos moleculares envolvidos no desenvolvimento de tecidos saudáveis ou tumorais. Mas a criação desses organoides não ocorreu da noite para o dia! Foi uma longa jornada de quase 30 anos de estudos.
No início dos anos 90, o grupo do professor Clevers foi o primeiro a descrever uma família de fatores de transcrição denominados TCF que estariam envolvidos em uma cadeia de reações químicas chamada “via de sinalização Wnt”. Essa via, altamente conservada na história evolutiva dos animais, era conhecida por regular a diferenciação celular que ocorre em eventos relacionados ao desenvolvimento embrionário, de tecidos e órgãos. Alguns anos depois, o grupo descobriu que a via Wnt também está envolvida com a biologia celular das células-tronco adultas, encontradas na medula óssea, no sangue do cordão umbilical e, em menor quantidade, nos diferentes órgãos do nosso corpo. Diferente das células-tronco embrionárias, presentes nos embriões e capazes de diferenciar-se em diferentes tipos celulares de qualquer tecido, as células-tronco adultas são classificadas como multipotentes pois se diferenciam em células específicas dependendo do tecido ou órgão de origem. Em estudos com células-tronco adultas provenientes do intestino delgado, o grupo do Professor Clevers relatou, por exemplo, que o fator TCF4 inibe a transcrição de um gene na via Wnt envolvido na diferenciação dessas células e formação/renovação de estruturas importantes como as criptas intestinais.
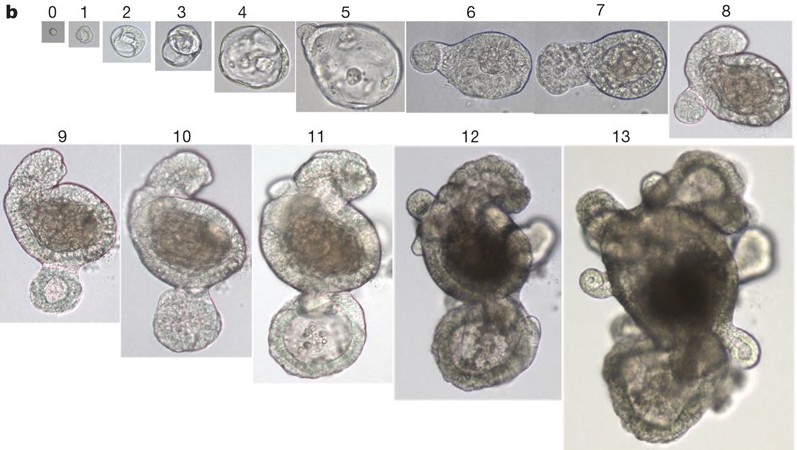
Imagem: modificada de Sato et al., 2009
Clevers, então, direcionou seus estudos para a identificação de quais receptores da via Wnt seriam os alvos desses fatores TCF e foi com os trabalhos de um de seus pós-doutorando, Nick Barker, que eles identificaram o gene lgr5. Como esperado, esses genes foram encontrados nas células-tronco adultas localizadas na região basal das criptas intestinais, aquelas responsáveis pela renovação das células desse tecido. No entanto, em estudos posteriores, Barker descobriu que essas células-tronco Lgr5+ tinham capacidade de dar origem a todos os outros tipos de células intestinais (grosso e delgado) dependendo de quais fatores de crescimento eram utilizados para serem estimuladas a se diferenciar. Mas uma dúvida ainda persistia, será que essas células Lgr5+ eram encontradas apenas no intestino? A resposta foi um curioso “não”. Barker e seus colaboradores descobriram que esses receptores eram encontrados em células de outros órgãos e tecidos como do folículo capilar, estômago e, provavelmente, de todos os outros tipos de células-tronco adultas epiteliais presentes nos corpos de mamíferos. Eles também relacionaram essas células-tronco Lgr5+ a origem de adenomas: tumores benignos do intestino. O gene lgr5+ passou a ser considerado, então, o principal marcador de células-tronco adultas.
Ao contrário do que se imaginava, as células-tronco adultas Lgr5+ podem se multiplicar constantemente, dependendo do órgão, ou apenas quando estes sofrem algum tipo de lesão, como no caso do fígado. Compreendendo melhor as cascatas de interação na via de sinalização Wnt que conduzem os eventos de multiplicação e diferenciação das células-tronco Lgr5+, em 2009 outro pós-doutorando do grupo do professor Clevers, Toshiro Sato, conseguiu formular um verdadeiro coquetel de fatores de crescimento capazes de fazer com que essas células se multiplicassem livremente nos cultivos in vitro. A grande surpresa aconteceu alguns dias depois que essas células foram colocadas em cultura. As células-tronco adultas Lgr5+ provenientes do intestino cresceram e se diferenciaram em diferentes tipos celulares, que se organizaram em uma estrutura tridimensional (3D) que parecia uma réplica do epitélio do intestino. Mais do que isso, essa estrutura 3D começou a produzir os compostos bioquímicos encontrados no órgão de origem. Criava-se então um organoide de intestino, ou seja, uma versão em ‘miniatura’ do epitélio do intestino, que por sua vez, era completamente funcional. Esse sistema de cultivo, baseado em células-tronco Lgr5+ e fatores de estímulo da via Wnt, permitiu que o grupo pudesse gerar em laboratório mini-intestinos, miniestômagos, organoides de fígado, próstata e rim, além de organoides de câncer de mama, ovário e cólon. Estudos posteriores mostraram que essas culturas de organoides replicam alguns aspectos de seu tecido de origem e são geneticamente e fenotipicamente estáveis. Devido a essas características, e também ao fato de serem produzidos em curto espaço de tempo, armazenados e manipulados facilmente, os organoides ajudam a compreender como os tecidos se desenvolvem e se recuperam de lesões, sendo uma ferramenta de pesquisa em diferentes áreas que vão desde a biologia do desenvolvimento e biologia celular até estudos de infectologia, toxicologia, doenças hereditárias e câncer. Não à toa, em 2013 a técnica foi eleita como um dos 10 maiores avanços da ciência atual pela revista The Scientist.
Grande destaque tem se dado ao uso desses miniórgãos como modelos de doenças a partir do crescimento de organoides provenientes diretamente do tecido doente de pacientes. Um exemplo de caso de sucesso é da fibrose cística. Hoje existem tratamentos para essa doença, no entanto são baseados em medicamentos, de custo bastante elevado, cuja eficácia varia muito de paciente para paciente. Em colaboração com a clínica de Fibrose Cística de Utrecht, a técnica de geração de miniórgãos do Instituto Hubrecht tem sido utilizada para geração de mini-intestinos a partir de biópsia do cólon de diversos pacientes diagnosticados com fibrose cística. A ideia é utilizar esses miniórgãos para testar medicamentos já existentes e novos fármacos para criar um banco de dados que pode ser acessado pelas companhias de seguro de saúde que irão custear o tratamento do paciente.
Outra doença que se destaca na gama de aplicações desses miniórgãos é o câncer. Os cultivos de organoides tumorais, gerados a partir de células individuais provenientes do tecido tumoral do paciente, permitem que os cientistas analisem de forma molecular e funcional esses tecidos e possam realizar testes de medicamento de uma maneira segura e confiável. Isso traz grandes avanços para a oncologia, uma vez que os modelos tradicionais baseados nos cultivos convencionais (bidimensional ou monocamada) de células tumorais não mimetizam de forma fidedigna o tumor que se desenvolve no corpo do paciente, e os estudos em modelos de camundongos geneticamente modificados (in vivo) podem levar até um ano para serem concluídos. Estudos têm mostrado que se há resposta do minitumor a um medicamento, são altíssimas as chances de que esse medicamento também fará efeitos no paciente de onde as células foram coletadas, o que representa uma verdadeira revolução na medicina personalizada. O foco agora é acrescentar, ao cultivo dos minitumores, células do sistema imune e de tecido conjuntivo para replicar características do microambiente tumoral e tornar esses modelos ainda mais similares a um câncer real.
Mas o que tudo isso tem a ver com estudos focados na COVID-19? Tudo! Vários pesquisadores têm aplicado a tecnologia de geração de organoides para entender a ação do vírus Sars-Cov-2, causador da doença COVID-19, no organismo. O grupo de pesquisa do professor Kazuo Takayama, da Universidade de Kyoto (Japão), foi um dos primeiros a desenvolver organoides brônquicos. Formados por quatro tipos de células, esses organoides apresentavam estruturas semelhantes aos brônquios e foram essenciais para entender como os vírus infectam estas células. Já o grupo de pesquisa da Professora Shuibing Chen da Escola de Pós-graduação em Ciências Médicas Weill Cornell Medicine (Nova Iorque) gerou organoides de pulmão, ou minipulmões, que além de estruturas semelhantes aos brônquios, também possuíam estruturas semelhantes aos alvéolos. Eles descobriram que o vírus induz a produção de quimiocinas e citocinas pelas células, desencadeando reações imunológicas e levando à morte celular. O próximo passo será o cultivo de minipulmões com células do sistema imune para entender exatamente as causas dessa morte celular.
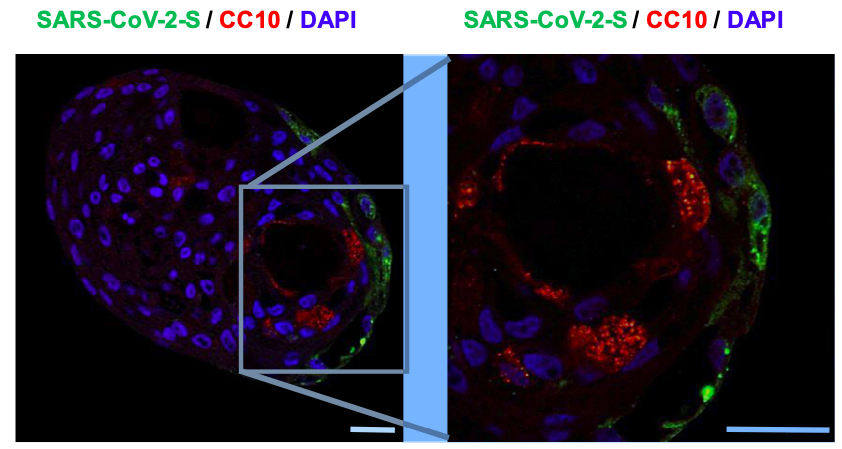
Mesmo sem saber que tipos de danos podem causar, já se sabe que o vírus Sars-Cov-2 é capaz de infectar outros órgãos e os mecanismos dessa infecção podem ser estudados em culturas de miniórgãos. O espalhamento do vírus pelo corpo provavelmente se dá através dos vasos sanguíneos e isso foi demonstrado pelo grupo da professora Núria Montserrat do Instituto de Bioengenharia de Catalão (Barcelona, Espanha) que identificou a capacidade do vírus Sars-Cov-2 em infectar culturas de organoides de vasos sanguíneos. No Brasil, dois grupos de pesquisa, do Instituto D’Or e da Universidade de Campinas, estão com pesquisas em andamento utilizando minicérebros para estudar se o Sars-Cov-2 é capaz de causar danos no sistema nervoso.
Portanto, existe um oceano de aplicações para esses miniórgãos, e as inovações nesse campo não param! Além dos modelos de doença, muitos grupos de pesquisa têm desenvolvido diferentes técnicas para obtenção de miniórgãos direcionados a outras finalidades. Por exemplo, alguns grupos de pesquisa já têm utilizado as células-tronco pluripotente induzidas (iPS) para criar os miniórgãos. Um grupo de pesquisa da Universidade de Pittsburgh (Estados Unidos) recentemente criou minifígados, a partir de células iPS, que foram transplantados em camundongos e se mostraram funcionais, secretando ureia e bile, assim como o fígado real. Foi a primeira vez que órgãos criados em laboratório se mostraram funcionais em modelos in vivo. O objetivo futuro é criar órgãos humanos para transplante e solucionar alguns desafios do processo de doação de órgãos, como problemas de compatibilidade.
–
Colaboração: Robson Amaral sobre o autor
Fontes consultadas:
– Artigo científico intitulado “Modeling development and disease with organoids”, publicado na revista Cell em 2016, de autoria de Clevers, H.
– Artigo científico intitulado “Identification of Candidate COVID-19 Therapeutics using hPSC-derived Lung Organoids”, publicado no repositório de preprints BioRxiv em 2020, de autoria de Han, Y.; Yang, L.; Xiaohua, D.;e colaboradores.
– Artigo científico intitulado “Lgr5+ intestinal stem cell sorting and organoid culture”, publicado na revista Animal Model Experimental Medicine em 2019, de autoria de Liu, R.; Li, H.; Cai, J.; e colaboradores.
– Artigo científico intitulado “Inhibition of SARS-COV-2 Infections in Engineered Human Tissues Using Clincal-Grade Soluble Human ACE2”, publicado na revista Cell em 2020, de autoria de Monteil, V.; Kwon, H.; Prado, P.; e colaboradores.
– Artigo científico intitulado “Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche”, publicado na revista Nature em 2009, de autoria de Sato, T.; Vries, R.; Snippert, H.; e colaboradores.
– Artigo científico intitulado “Generation of human Bronchial organoids for SARS-COV-2 research”, publicado no repositório de preprints BioRxiv em 2020, de autoria de Suzuki, T.; Itoh, Y.; Sakai, Y.; e colaboradores.
– Artigo científico intitulado “Assembly and Function of a Bioengineered Human Liver for Transplantation Generated Solely from Induced Pluripotent Stem Cells”, publicado na revista Cell Reports em 2020, de autoria de Takeishi, K.; l’Horlet, A.; Wang, T.; e colaboradores.
– Artigo científico intitulado “Cancer modeling meets human organoid technology”, publicado na revista Science em 2019, de autoria de Tuveson, D. e Clevers, H.– Artigo científico intitulado “Patient-derived organoids model treatment response of metastatic gastrointestinal cancers”, publicado na revista Science em 2018, de autoria de Vlachogiannis, G.; Hedayat, S.; Vatsiou, A.; e colaboradores.

- Quer ser o próximo autor colaborador do Ilha do Conhecimento? Participe!
- Não perca mais nenhuma postagem: Acompanhe nosso projeto nas redes sociais!
(Editoração: Fernando Mecca, Eduardo Borges e Caio Oliveira)