A avaliação da Agência aponta falhas no desenvolvimento e na produção do imunizante, indicando a ineficiência ou ausência de dados de controle de qualidade, segurança e eficácia do produto.
Nesta semana a análise da Anvisa sobre a vacina russa Sputnik V foi concluída e resultou na negação da importação da vacina para uso emergencial. Entre os principais motivos está o comprometimento da sua segurança, uma vez que foram identificados adenovírus replicantes na composição do imunizante.
A Gam-COVID-Vac (nome oficial da Sputnik V), utiliza dois tipos de adenovírus como vetores, o adenovírus 5 (Ad5) e o 26 (Ad26). No geral, para aplicação como vetores em vacinas os vírus são inativados e perdem sua capacidade de se replicar no organismo humano. No entanto, diferentemente do esperado, os técnicos da Anvisa constataram que o vírus Ad5 havia conseguido se recombinar, ou seja, trocar pedaços de seu material genético com outros fragmentos de vírus presentes e se rearranjar, recuperando a capacidade de replicação. Sobretudo isso indica uma falha no controle de qualidade da vacina. No entanto, especialistas afirmam que não há risco de reações graves para quem é imunizado com esta vacina. Em humanos, o adenovírus causa apenas resfriados. Confira mais detalhes a seguir.
O emprego de vetores virais em vacinas
Existem diversas metodologias para a produção de vacinas. As primeiras a serem produzidas, utilizavam os agentes patogênicos inteiros em sua composição, vivos, mortos ou atenuados, introduzindo-os no organismo humano para então estimular a imunidade contra a doença. Apesar de antiga, esta tecnologia ainda é empregada nos dias atuais e é o caso da tecnologia da Coronavac, criada pela Sinovac e produzida no Brasil pelo Instituto Butantan, que usa o coronavírus inativado na sua composição.
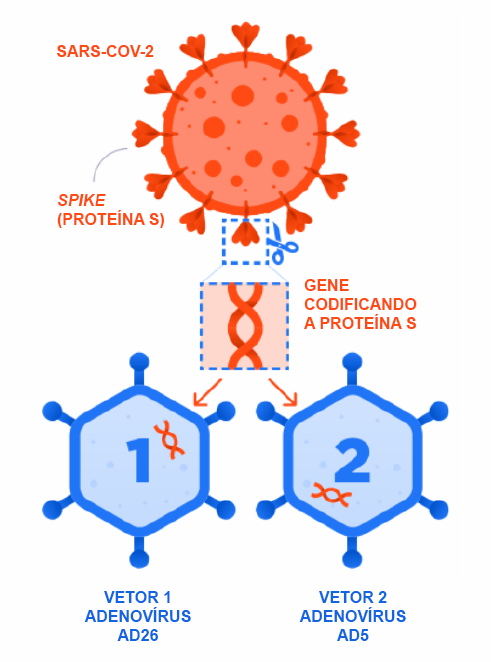
Em uma segunda geração de vacinas, utiliza-se apenas parte do agente patogênico, com uma proteína ou o código genético para essa proteína, para estimular a reação imunológica no organismo. Essa proteína ou o código, por sua vez, necessitam ser transportados para dentro das células do organismo humano por meio de um vetor e é onde entram os vírus, que são empregados como vetores nesta etapa. É o caso da vacina Sputnik V, da vacina Oxford-AstraZeneca, e das vacinas da Janssen e da CanSino.
Já as vacinas feitas com tecnologias mais modernas, também chamadas de terceira geração, utilizam RNA mensageiro, que é um material genético que contém o código para produção de uma proteína. Assim a proteína do agente patogênico é produzida já dentro do próprio organismo humano e estimula a produção dos anticorpos. Esse tipo de vacina também é chamada de vacina gênica ou vacina genética. As vacinas da Pfizer/Biontech e da Moderna usam essa tecnologia.

Dentre as vacinas que utilizam vetor viral, é comum a utilização do adenovírus como vetor e isso não é exclusividade só da Sputnik V, produzida pelo laboratório Gamaleya. Eles são usados como vetores virais em pelo menos quatro vacinas contra o coronavírus utilizadas no mundo: Oxford-Astrazeneca, Janssen, Sputnik V e CanSino. Com exceção da vacina Oxford-Astrazeneca, que usa adenovírus de chimpanzés na sua composição. As demais citadas usam adenovírus humanos para transportar o código genético da proteína Spike, encontrada no Sars-CoV-2, para dentro da célula humana. Em todas elas, os adenovírus são inativados, ou seja, perdem sua capacidade de se multiplicar no organismo humano. No entanto, quando esse vírus não é eficientemente inativado, ele mantém a capacidade de se multiplicar, e pode então transmitir o resfriado, deixando a pessoa que foi imunizada doente.
Segundo o cientista Oscar Bruna-Romero, professor de doenças infecciosas e vacinas no Departamento de Microbiologia da Universidade Federal de Santa Catarina (UFSC), o vírus replicante em si não é um problema grave – e, sim, qual a frequência em que ele ocorre. O ideal, por exemplo, é que ele não apareça em quantidade suficiente para causar sintomas. A grande questão é que a presença de vírus replicantes deve ser um fator bem controlado. No entanto, o laboratório russo não divulgou o quanto e nem a forma como controlam e como sabem a quantidade de vírus replicativo presente nos imunizantes, relatou o pesquisador. O cientista também lembra, ainda, que o problema do vírus se replicando nunca vai ser tão grande quanto o da Covid. “O adenovírus replicante faz um resfriado. Mesmo que fosse um caso extremo [com] a vacina, em todos esses supostos casos a pessoa nunca passaria tão mal quanto se pegasse Covid”, frisa. Os diretores da Anvisa, no entanto, temem pela ocorrência de reações graves caso a vacina fosse administrada em pessoas com baixa imunidade e problemas respiratórios, entre outros problemas de saúde.
Em nota, o Centro Gamaleya e o Fundo Russo afirmaram que realizam “um controle de qualidade rigoroso de todos os locais de produção da Sputnik V, confirmou que nenhum adenovírus competente para replicação (RCA) foi encontrado em qualquer um dos lotes de vacina Sputnik V que foram produzidos”.
Como o vírus é inativado?
Quando o adenovírus Ad5 vai ser aplicado como vetor de uma vacina, os cientistas retiram dele um gene que o torna capaz de replicar o seu material genético, chamado de gene E1. Essa retirada do gene se chama deleção. Após a deleção, o vírus perde a capacidade de se replicar em todo tipo de célula – e isso inclui as nossas, explica Oscar Bruna-Romero. Para garantir que o mecanismo funcionou – que o vírus não está se replicando ou não se recombinou de alguma forma – os pesquisadores colocam esse vírus que sofreu o processo de deleção dentro de uma célula. Se ele não se replicar, é porque a vacina passou no teste de qualidade. “O errado na vacina Sputnik V é que a Rússia não está explicando adequadamente como faz o controle de qualidade da vacina para que isso não aconteça”, explica Bruna-Romero.
Isso não significa que a vacina deu errado ou está totalmente descartada. A vacina ainda pode ser aprovada para importação e ser produzida no país, desde que a União Química (farmacêutica que pretende produzir a Sputnik V no Brasil) seja capaz de fazer o mesmo controle de qualidade que estão fazendo outros laboratórios que também produzem vacinas com vetores virais, como é o caso da Janssen e da AstraZeneca.
As especificidades da Sputnik V
Entre todas as vacinas contra a Covid-19 já registradas no mundo, a Sputnik V é a única desenvolvida com dois adenovírus, aplicados um em cada dose, o que pode ser considerado duas vacinas em uma. Na primeira dose, o Ad26 leva a proteína S para dentro das células humanas, o que estimulará uma resposta do sistema imunológico, que começa a criar células de defesa e anticorpos contra a proteína e, consequentemente, contra o coronavírus.
Na segunda dose, que é aplicada 21 dias depois, é introduzido o Ad5, outro adenovírus que terá a mesma função, mas, ao mesmo tempo, tende a ser o diferencial mais assertivo do imunizante. Em teoria, a estratégia russa pode reduzir o risco de que uma eventual resistência do organismo contra o adenovírus atrapalhe a resposta imunológica. Então, segundo cientistas, por ter duas ‘fórmulas’ diferentes, essa vacina pode ajudar a produzir mais anticorpos contra o coronavírus e provavelmente essa estratégia é a responsável pela alta eficácia (mais de 90%) do imunizante contra o vírus Sars-CoV-2.
Outros motivos que levaram à negação da Anvisa
De acordo com a análise, foram identificadas falhas no desenvolvimento do produto, em todas as etapas dos estudos clínicos (fases 1, 2 e 3). Também há ausência ou insuficiência de dados de controle de qualidade, segurança e eficácia. A questão mais preocupante foi justamente com relação à capacidade de replicação dos adenovírus e o potencial risco de o imunizante causar infecções. Esse conjunto de falhas, portanto, foge dos padrões de qualidade recomendados pela Organização Mundial da Saúde (OMS) e pelo Conselho Internacional para Harmonização de Requisitos Técnicos de Medicamentos para Uso Humano (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH), seguidos pelas principais agências reguladoras do mundo, incluindo a Anvisa.
Além disso, foram detectados estudos de caracterização inadequados da vacina, inclusive com relação à análise de impurezas e de vírus contaminantes durante o processo de fabricação. Também houve ausência de validação/qualificação de métodos de controle de qualidade, entre diversos outros aspectos. Foi verificada, ainda, a ausência de testes de toxicidade reprodutiva, que permitem verificar se o produto pode ou não ser prejudicial às células reprodutivas.
Quanto à uma missão de inspeção enviada à Rússia, de acordo com a Anvisa, a falta de relatório técnico de aprovação do produto culminou na necessidade de inspeção presencial para permitir a avaliação das condições de fabricação das empresas envolvidas na produção do insumo farmacêutico biológico e da vacina. Durante a visita, não foram identificadas condições de fabricação que demonstrassem que os produtos são consistentemente fabricados e controlados, resultando em um produto com a qualidade requerida para o uso pretendido. A diretoria informou ainda que, em solo russo, foi negado à equipe de inspeção o acesso às instalações do Gamaleya, instituto desenvolvedor da vacina.
De acordo com o relator do processo, diretor Alex Machado Campos, a decisão de não autorização é um retrato do momento. Ele destacou que a Anvisa é conhecida por viabilizar o acesso a medicamentos e vacinas e que, neste momento de pandemia, a instituição tem atuado no limite, mas que não há flexibilização em relação à segurança dos produtos.
News: Jéssica Soares
Fontes e mais informações sobre o tema:
Matéria no site CNN Brasil, intitulada “Adenovírus replicantes: o que são e quais os riscos quando usados em vacinas”, publicada em 28 de abril de 2021.
https://www.cnnbrasil.com.br/saude/2021/04/28/adenovirus-replicantes-o-que-sao-e-quais-os-riscos-quando-usados-em-vacinas
Matéria no site G1, intitulada “Adenovírus replicante na vacina Sputnik V: entenda o que levou Anvisa a negar importação”, publicada em 27/04/21.
https://g1.globo.com/bemestar/vacina/noticia/2021/04/27/adenovirus-replicante-entenda-a-questao-que-levou-a-anvisa-a-negar-a-importacao-da-vacina-sputnik-v.ghtml
Notícia no site do Governo Federal, intitulada “Anvisa não aprova importação da vacina Sputnik V”, publicada em 28 de abril de 2021.
https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2021/anvisa-nao-aprova-importacao-da-vacina-sputnik-v#:~:text=Avalia%C3%A7%C3%A3o%20de%20dados%20dispon%C3%ADveis%20at%C3%A9,seguran%C3%A7a%20e%20efic%C3%A1cia%20do%20produto.
(Editoração: André Pessoni)

