Resultados de testes clínicos aproximam diferentes vacinas do pedido de aprovação para uso. A parceria entre Pfizer e BioNTec conseguiu o feito nos Estados Unidos.
A corrida pela vacina contra Covid-19 teve um avanço importante nos últimos dias. Na sexta-feira (20), as farmacêuticas Pfizer e BioNTec pediram autorização da FDA, agência que regula medicamentos e alimentos nos Estados Unidos, para usar sua vacina de forma emergencial no país. O pedido se baseia nos resultados da fase 3 dos testes clínicos, que apresentaram 95% de eficácia segundo anúncio das duas farmacêuticas. Nesta fase, a vacina foi testada em um grande número de pessoas.
Apesar de o foco ter se voltado para a Pfizer-BioNTec, elas não são as únicas empresas com vacinas em etapas finais de desenvolvimento. Veja a seguir as cinco vacinas mais avançadas contra Covid-19 e entenda em que fase elas se encontram.
1. BNT162 (Pfizer e BioNTech)
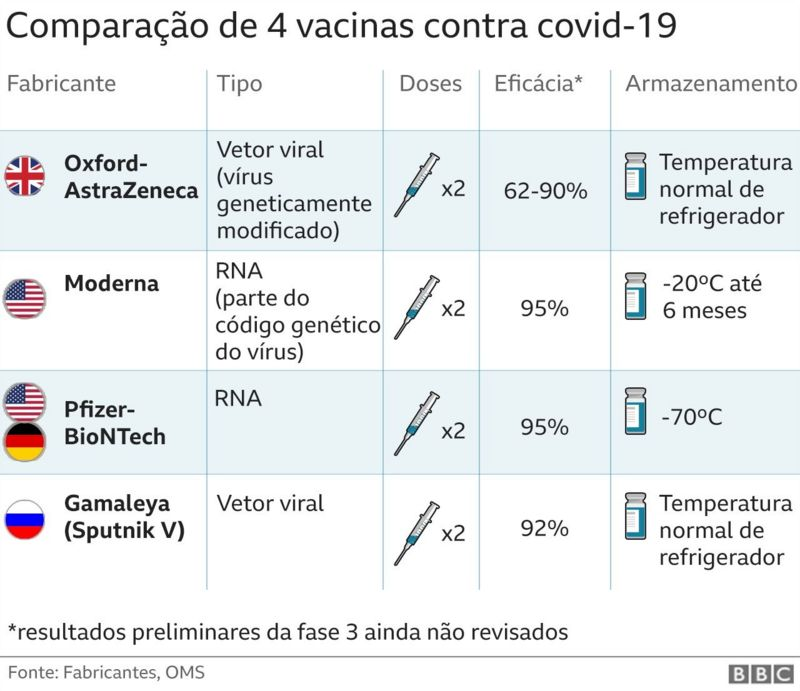
A vacina da Pfizer e BioNTech foi testada em mais de 43 mil voluntários de seis países: África do Sul, Alemanha, Argentina, Brasil, Estados Unidos e Turquia. Os resultados foram analisados depois que 170 participantes dos testes tiveram Covid-19. Do grupo de contaminados, apenas 8 tinham tomado a vacina. Os outros 162 (95%) receberam uma substância inativa (placebo), o que replica o processo de vacinação sem causar ação imunológica. Os testes indicam que a eficácia é garantida após 28 dias de aplicação da primeira dose.
A vacina da Pfizer é feita com RNA, que é uma sequência de material genético. No caso, o RNA é produzido com base no código genético do vírus de interesse. O objetivo é que as células humanas usem a sequência presente na vacina para produzir proteínas parecidas com as do novo coronavírus, o que faz com que o sistema imunológico aprenda a reconhecer as proteínas e desenvolva uma resposta de proteção. Em caso de infecção pelo vírus no futuro, o sistema imunológico já sabe como reagir e fazer a defesa do corpo.
A previsão é de que a FDA (do inglês Food and Drug Administration – Agência de Drogas e Alimentos) apresente uma decisão sobre o uso da vacina em meados de dezembro. Se aprovada, esta será a primeira vacina genética do mundo. Sua avaliação também está em andamento na União Europeia, Reino Unido, Canadá, Austrália e Japão.
A Pfizer afirma que poderá fornecer 50 milhões de doses ainda em 2020. Como a vacina é aplicada em duas doses, a quantidade seria suficiente para proteger 25 milhões de pessoas. A produção inicial das farmacêuticas está inclusa em um pacote comprado em julho pelo governo dos Estados Unidos, que pagou cerca de R$ 10 bilhões por 100 milhões de doses que seriam produzidas em 2020 e 2021. O Brasil anunciou que iniciou as conversas com a empresa em novembro, mas ainda não há um acordo de compra.

2. mRNA-1273 (Moderna)
Outra vacina baseada em RNA, e também com duas doses, tem sido desenvolvida pela Moderna. Por enquanto, a farmacêutica aguarda que os testes clínicos atinjam o número mínimo de infectados no estudo para fazer as análises necessárias ao pedido de aprovação de uso. Já foram 95 participantes diagnosticados com Covid-19, com taxa preliminar de eficácia da vacina calculada em 94%.
Uma grande vantagem desta candidata é sua forma de armazenamento. Enquanto a vacina da Pfizer precisa ser guardada a -70 °C, a da Moderna pode ser armazenada a -20 °C, temperatura mais fácil de atingir em aparelhos de refrigeração menos potentes.
Ainda não há previsão de quando a vacina estará autorizada para uso nem de quando será distribuída no Brasil.
3. AZD1222 (Universidade de Oxford e AstraZeneca)
Ao contrário das vacinas anteriores, esta candidata foi desenvolvida com base em um vetor viral. Ou seja, os cientistas utilizaram um tipo de vírus muito comum na produção de vacinas (o adenovírus) para carregar o material genético do Sars-Cov-2, causador da Covid-19. No processo, os pesquisadores retiraram o gene responsável pela replicação do adenovírus, o que faz com que ele perca a capacidade infecciosa. Depois que a ameaça de replicação é neutralizada, o material genético do coronavírus é colocado no adenovírus para que ele transporte o material até as células humanas. A presença do vetor viral no corpo desencadeia a resposta imunológica e garante proteção contra futuras infecções.
A vacina está na fase de testes clínicos e os resultados iniciais indicam uma eficácia de 62% a 90%. Apesar da variação, a candidata de Oxford tem duas grandes vantagens: ela pode ser armazenada em refrigeradores comuns e sua produção é mais barata. Além disso, o Brasil tem um acordo para compra e transferência da tecnologia de fabricação da vacina, que será feita na Fundação Oswaldo Cruz.
Mas a vacina tem sofrido duras críticas devido a erros na administração das doses a uma parcela dos participantes dos testes. Especialistas também indicaram algumas irregularidade na apresentação dos resultados. Em comunicado oficial, a AstraZeneca alegou que realizou os testes seguindo os padrões de qualidade e que agiu rapidamente para corrigir os erros identificados.
4. Sputnik V (Instituto de Pesquisa Gamaleya em Epidemiologia e Microbiologia)
A vacina desenvolvida na Rússia foi uma das primeiras a ter sua aprovação anunciada pelo governo. Em agosto, o presidente Putin já havia declarado liberação regulatória, apesar de os testes em larga escala não estarem concluídos. Os testes estão em andamento com cerca de 40 mil voluntários na própria Rússia e em países parceiros, como Belarus e Emirados Árabes Unidos.
O princípio da vacina também é o de vetor viral, assim como a de Oxford, e as taxas de eficácia reportadas estão em torno de 92%. Mas o número mínimo de 150 participantes contaminados, que serve de base para o pedido de aprovação nos Estados Unidos, ainda não foi atingido.
No Brasil, a vacina foi alvo de acordo entre a Rússia e o governo do estado do Paraná em agosto. Na época, o acordo foi definido como uma aproximação, sem compromisso de compra ou fabricação da vacina. Já na escala federal, o Ministério da Saúde declarou manter a via de negociação aberta em relação à Sputnik V.
5. Coronavac (Sinovac)
A vacina produzida pela farmacêutica chinesa em parceria com o Instituto Butantan atingiu o número mínimo de participantes infectados para entrar em fase de análises pré-aprovação. Entre os 13 mil voluntários nos testes, 61 precisavam ter contraído Covid-19. Na última segunda-feira (23), o Instituto Butantan e o governo do estado de São Paulo anunciaram a ocorrência de 74 infectados. A fase preliminar (chamada de interina) pode ser complementada por análise posterior, depois que os casos da doença entre os voluntários somarem 154.

A Coronavac seguiu um modelo mais tradicional de produção de vacinas, que se baseia no vírus inativo. Ou seja, a vacina é produzida com o próprio coronavírus, que foi cultivado e inativado em laboratório. Ao ter contato com o vírus, o corpo reage produzindo anticorpos, que são proteínas de defesa.
Os próximos passos da Coronavac são as análises de eficácia e o envio para o comitê internacional que controla a pesquisa. Depois disso, os resultados serão enviados para a Agência Nacional de Vigilância Sanitária (Anvisa) e para a agência reguladora da China.
O estado de São Paulo tem um contrato com a Sinovac para comprar 46 milhões de doses. Seis milhões serão importadas direto da China, com previsão de chegada até o fim de dezembro. O material para as outras 40 milhões também será importado, mas as etapas de envase e rotulação serão feitas no Instituto Butantan.
News: Luanne Caires
Fontes e mais informações sobre o tema:
Matéria no site BBC News Brasil, intitulada “Covid-19: os pontos fracos e fortes das vacinas mais adiantadas”, publicada em 19/11/2020.
https://www.bbc.com/portuguese/geral-54995983
Matéria no site G1, intitulada “Pfizer pede autorização a agência dos EUA para uso emergencial de vacina contra a Covid-19″, publicada em 20/11/2020.
https://g1.globo.com/bemestar/vacina/noticia/2020/11/20/pfizer-pede-autorizacao-para-uso-emergencial-de-vacina-contra-covid-19-nos-eua.ghtml
Matéria no site G1, intitulada “Estudo da CoronaVac atinge número mínimo de voluntários infectados pela Covid-19 e entra na fase final de aprovação”, publicada em 23/11/2020.
https://g1.globo.com/sp/sao-paulo/noticia/2020/11/23/estudo-da-coronavac-atinge-numero-minimo-de-voluntarios-infectados-pela-covid-19-e-entra-na-fase-final-de-aprovacao.ghtml
(Editoração: André Pessoni)

